Lab. Clin. Pract., 19(2) : 84-88 (2001)
第11回 春季大会記録
特別講演:私のライフワーク
私のライフワーク
大阪医科大学病態検査学・中央検査部
清 水 章
1. 研究のスタート
筆者は1963年,内科学(阪大第三内科)の大学院生として研究を開始した.免疫グロブリンの構造の研究で始まったが,まもなく,異常ヘモグロビン(Hb)疑いの症例について,その正確な診断のために,Hbの構造を調べ,HbM (α58His→Tyr) であることを決定し,光学的特徴を明らかにした.大学院終了後,1年間の市民病院勤務の後,アメリカ,インディアナ大学に留学,再び免疫グロブリンの研究に従事し,共同研究者とともに,IgMの全構造を明らかにした.さらに免疫グロブリン遺伝子の再構成機序を示唆する重要なアミノ酸配列の知見を発表した.その後の免疫グロブリン遺伝子全貌解明の端緒であったと考える.また,筆者の示したIgM糖鎖構造のモデルは,30年後の今も,世界で最も広く読まれている免疫学の教科書(Roitt, et al. 編:Gower Medical Publishing Ltd., London. 日本語訳,南江堂)の表紙になっていることを,第11回春季大会の講演にて,スライドで示した.帰国後は,核磁気共鳴(NMR)を用いて免疫グロブリンの高次構造の研究を行った.その中で,IgG3の435番目のアミノ酸が当時Argと報告されていたが,NMRの結果からHisであることを突き止めた.我々の分析したIgG3はstと呼ぶアロタイプを有していた.すなわち,stは東洋人種に特異的であり,この場合は435番がHisであって,当時欧米で報告されていたstをもたないIgG3ではArgであるという結論が得られた.アロタイプstは大阪医大法医学松本秀雄教授(後学長)らが発見した東洋人種独特のものであり,これをマーカーとして,日本人の起源を明らかにした松本一門の研究は有名である.
その後,筆者はずっとタンパク質の構造と病気の関係に興味をもち続けてきた.遺伝子解析で,容易にアミノ酸配列が推定されるようになった今日でも,やはりタンパク質にこだわっている.優れた共同研究者に恵まれ,今,ソフトイオン化(分子を壊さない)質量分析をフルに用いて,ポストゲノム時代の臨床検査の扉を開こうとしている.質量分析によるアミノ酸配列構造決定の技術は,遺伝子分析で推定した構造を裏づけることができるし,遺伝子解析では不可能な修飾構造を知ることができる.これまでのタンパク質化学の手法に比し,分析に要する労力が小さく,小量の試料ですみ,変異タンパク質,修飾構造をもつタンパク質,従来法では同定が不可能であった微量タンパク質を分析し,新しい病気診断,病態研究に応用することができるのである.
表1〜3にこれまでに分析した,Hb,トランスフェリン,トランスサイレチン,銅亜鉛スーパーオキシドジスムターゼの疾病における構造変化を示した.世界で初めての変異の報告,遺伝子技術ではわからないユニークな翻訳後修飾構造や糖鎖構造異常を明らかにした.多くは病気の診断に寄与したし,タンパク質の構造と機能の関連に示唆を与えた.ペプチド分離に用いる液クロのサイズは今,1963年当時の 1/60, 750 である.今では,それだけ試料は少なくてすみ,分析時間が短縮されていると言っていい.キャピラリーカラム先端にポリマー系あるいはシリカ系逆相樹脂を充填し,カラムを質量分析系に直結させ感度を上げると,ペプチドであれば,10−15(フェムトモル)モルでの分析が可能である.
二次元電気泳動の染色スポットを分析し,アミノ酸配列からタンパク質が高感度短時間に同定できるまでになった.ほぼ全塩基配列がわかっているので,ペプチドの構造が断片的にわかっただけで新しいタンパク質が見つかるのである.この技術はプロテオミクスと呼ばれ今後一般的になる.今教室では,数種の体液・細胞について,スポットの網羅的同定(カタログ作り)を進めている.
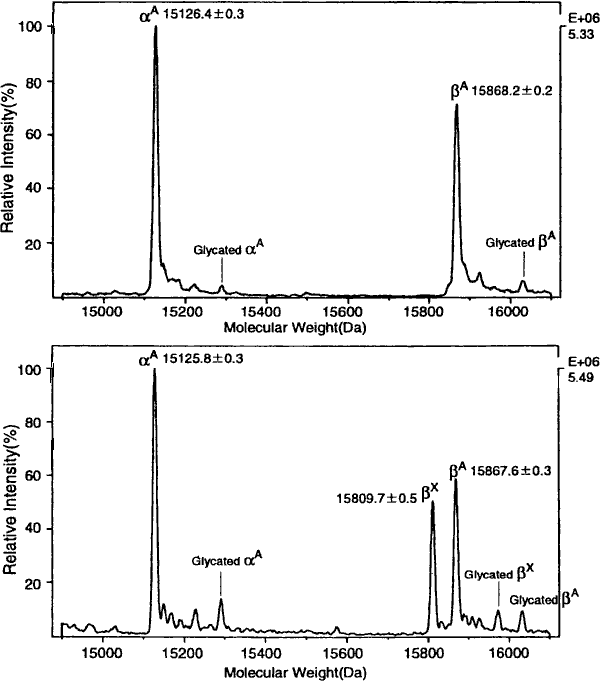
図1 ヘモグロビンのESI質量分析による分子量換算スペクトル (transformed ESI mass spectrometry)(サーモクエスト社,TSQ-7000)
上段:正常コントロール,下段:異常ヘモグロビン・Hb Hokusetsu ( β52Asp→Gly) ヘテロ接合体.下段の β-subunit のピークは2本に分かれており,質量数差はアスパラギンとグリシンの差58を表している.コントロールも症例も共にそれぞれのサブユニットに糖化成分(glycated α とβ)(+162 Da)を伴っている.
| 表1〜3 質量分析によるタンパク質構造異常の検出・同定,大阪医大病態検査学教室の依頼あり分析した症例(1994〜2001) |
| 表1 異常ヘモグロビン |
ヘモグロビン 変異部位・質量数差 症例数 ―――――――――――――――――――――――――――――――――――――――――――――――――――――――― α-Subunit I-Interlaken α15Gly→Asp (+58 Da) 1 Le Lamentin α20His→Gln (−9 Da 2 M Boston α58His→Tyr (+26 Da) 1*** J-Meerut α120Ala→Glu (+58 Da) 1 β-Subunit Raleigh β1Val→acLeu (+14 Da) 1 Niigata β1Val→Met-Leu (+145 Da) & acMet-Leu (+187 Da) 3* Okayama β2His→Gln (−9 Da) 1 SC複合へテロ接合体 β6Glu→Val (−30 Da) & β6Glu→Lys (−1 Da) 1 Codon17A→T β17Lys→stop 1## E-saskatoon β22Glu→Lys (−1 Da) 1 Eホモ接合体 β26Glu→Lys (−1 Da) 2 E β26Glu→Lys (−1 Da) 1 Hoshida β43Glu→Gln (−1 Da) 2 Hokusetsu β52Asp→Gly (−58 Da) 1* Hamadan β56Gly→Arg (+99 Da) 11 J-Lome β59Lys→Asn (−14 Da) 4 Bristol β67Val→Met (+32 Da)→Asp (+16 Da) 2 Tigraye β79Asp→His (+22 Da) 1** G-Szuhu β80Asn→Lys (−14 Da) 5 Hb Providence β82Lys→Asn (−14 Da)→Asp(−13 Da) 1 Santa Ana β88Leu→Pro (−13 Da) 1** Agenogi β90Glu→Lys (−1 Da) 1 Yoshizuka β108Asn→Asp (+1 Da) 1 Peterborough β111Val→Phe (+48 Da) 1** Masuda β114Leu→Met (+18 Da) & 119Gly→Asp (+58 Da) 1 Riyadh β120Lys→Asn (−14 Da) 6 Takamatsu β120Lys→Gln (+/−0 Da) 1 Comden β130Gln→Glu (+1 Da) 1* Montfermeil β130Tyr→Cys (−60 Da) 1** Sagami β139Asn→Thr (−13 Da) 1*# |
* 世界第一例 ** 我が国第一例 *** 1964年発見,通常法で構造決定し,MS分析は1981年FDMS法により,1994年ESI-MS法により構造を確認した. # β+サラセミアと異常ヘモグロビンの複合へテロ接合体 ## β0型サラセミア(中国人) ホモ・ヘテロの区別の書いていないものはすべてヘテロ接合体 |
| 表2 トランスサイレチンとCu/Zn-スーパーオキシドジスムターゼタンパク質 |
タンパク質 変異部位・質量数差 症例数
―――――――――――――――――――――――――――――――――――
TTR 18Asp→Glu (+14 Da) 2
30Val→Met (+32 Da) 25
36Ala→Pro (+26 Da) 1
38Asp→Ala (−44 Da) 2*
47Gly→Ala (+14 Da) 2
49Thr→Ile (+12 Da) 2*
50Ser→Ile (+26 Da) 3
50Ser→Arg (+69 Da) 1
60Thr→Ala (−30 Da) 4**
101Gly→Ser (+30 Da) 1*
109Ala→Ser (+16 Da) 2
114Tyr→Cys (−60 Da) 6
―――――――――――――――――――――――――――――――――――
SOD-1 4Ala→Ser (+16 Da) 1*
37Gly→Arg (+99 Da ) 1
46His→Arg (+19 Da) 1
86Asn→Ser (−27 Da) 1
111Cys→Tyr (+60 Da) 1*
|
| * 世界第一例 ** 我が国第一例 |
| 表3 異常修飾構造タンパク質の検出による診断 |
症例数 ――――――――――――――――――――――――――――――――――― モリブデン補因子欠損症,S-sulfonated TTR の検出 3 糖鎖欠損糖蛋白症候群,Asn結合糖鎖の欠損成分の検出 2 |
2. 異常ヘモグロビン(Hb)の構造およびHbA1c
表1に示すように,これまで教室では多数の依頼検体について正しい診断結果を報告してきた.これらのうち,溶血性貧血やチアノーゼ様の症状を示すものは数例であり,大部分はHPLCによるHbA1c値のプロフィルの異常や血糖値などとの不一致から見いだされた.一方,我々はESI-MSを用いてHbA1cの真値に近い値を求める標準法を確立した.教室で構造決定したすべての異常ヘモグロビンについてHPLCおよび免疫法による値とESI-MSによる正確な値を比較した.それぞれの異常Hbがそれぞれの測定法によって示す正または負の誤差の程度を明らかにした.日常用いられているHbA1cの測定系はいずれも,異常Hb含有検体を測定した場合,何らかの間違った結果を示す.別の表現をすると,いずれの測定系も,異常Hb含有検体に対して完全なものはない.
免疫法では大部分の種類の異常Hbに対してほぼ正確な値を与える.しかし少数例ではあるが抗体の反応が低下している場合があり,これらに対しては気づかれないだけに誤診の可能性が高い.HPLC法は血糖値との不一致やHPLC溶出パタンの変形から異常Hbの存在が示唆される.しかし異常成分の比率の少ないとき,例えばα鎖異常では異常鎖が1/4であってHbA1cは3/4になるだけであり,現行HPLCでは見落とし,誤診につながる可能性が高い.
異常Hb含有検体に対しても正しい値を出すためには, 高分離能の HPLC を用い A1c/A0 を出すようにする必要がある.(現行,我が国ではA1c/Total Hb を用いている.)あるいはHbA1c測定と同時に一度は異常Hb有無のチェックをするのが理想であろう.網状赤血球増加などHbA1c値が糖尿病の指標として使えない場合をピックアップすることなども必要かと考える.
3. その他のタンパク質
異常Hb分析で培った技術を広げて,トランスフェリン,トランスサイレチン (TTR), Cu, Zn スーパーオキシドジスムターゼ(SOD-1)についても分析し,5新種,1我が国第一例を含む多数例を同定した(表2).TTRの変異は家族性アミロイドポリニューロパチーの原因であり,SOD1の変異は家族性筋萎縮性側索硬化症の一部の原因である.質量分析はタンパク質変異だけではなく,タンパク質修飾構造の検出・同定にも有用であり,モリブデン補因子欠損症において亜硫酸結合TTRが著しく増加していることを見いだした.また,糖鎖欠損糖タンパク質症候群患者のトランスフェリンに,糖鎖がアスパラギン結合部位から欠けている成分が検出できることを示した(表3).このとき,タンパク質試料の調製法として我々が提唱した免疫沈降法がTTR,SOD1の分析にも有用であり,国内外のこれら疾患に取り組んでいる多くの研究機関で,この方法が採用されている.謝 辞 TTRは宮崎医科大学の中里雅光先生,熊本大学の安東由喜雄先生との,SOD-1は主に大阪大学の佐古田三郎教授との,またモリブデン補因子欠損症は久留米医大の芳野信教授との共同研究の成果である.また,多くの指導者・共同研究者に恵まれ,深く感謝の意を表します.
主な指導者・共同研究者
ヘモグロビン:林 昭(当時阪大助手,後に大阪府立母子保健総合医療センター副院長・企画調査部長),山村雄一(阪大教授・総長)
免疫グロブリン:Prof. Frank W. Putnam (Indiana Univ.), 荒田洋治(当時東大理学部助教授,後に東大薬学部教授)
質量分析:中西豊文(大阪医科大学病態検査学講師),岸川匡彦(同学内講師),宮崎彩子(同助手),中川俊正(同助教授)
文 献
主要原著論文1) Shimizu, A., Hayashi, A., Yamamura, Y., Tsugita, A., and Kitayama, K.: The structural study on a new hemoglobin variant, Hb M Osaka. Biochim. Biophys. Acta, 97, 472-482 (1965).
2) Hayashi, A., Shimizu, A., Yamamura, Y., and Watari, H.: Hemoglobin M: Identification of Iwate, Boston, and Saskatoon variants. Science, 152, 207-208 (1966).
3) Kohler, H., Shimizu, A., Paul, C., Moore, V., and Putnam, F. W.: Three variable gene pools common to IgM, IgG and IgA immuno-globulins. Nature, 227, 1318-1320 (1970).
4) Shimizu, A., Putnam, F. W., Clamp, J. R., and Johnson, I.: Structure and role of the five glycopeptides of human IgM immunoglobulins. Nature New Biology, 231, 73-76 (1971).
5) Putnam, F. W., Florent, G., Paul, C., Shinoda, T., and Shimizu, A.: Complete amino acid sequence of the Mu heavy chain of human IgM immunoglobulin. Science, 182, 287-291 (1973).
6) Shimizu, A., Honzawa, M., Yamamura, Y., and Arata, Y.: Proton nuclear magnetic resonance studies of human immunoglobulins. Solution conformation of constant domain of the light chains and identification of the isotypes. Biochemistry, 19, 2784-2790 (1980).
7) Shinoda, T., Takayasu, N., Takayasu, T., Okumura, T., and Shimizu, A.: Complete amino acid sequence of the Fc region of a human delta chain. Proc. Natl. Acad. Sci. USA, 78, 785-789 (1981).
8) Mizuochi, T., Taniguchi, T., Shimizu, A., and Kobata, A.: Structural and numerical variations of the carbohydrate moiety of immunoglobulin G. J. Immunol., 129, 1295-2016 (1982).
9) Shimizu, A., Honzawa, M., Ito, S., Miyazaki, T., Matsumoto, H., Nakamura, H., Michaelsen, T. E., and Arata, Y.: 1H NMR studies of the Fc region of human IgG1 and IgG3 immuno-globulins: assignment of histidine resonances in the CH3 domain and identification of IgG3 protein carrying G3m(st) allotypes. Molec. Immunol., 20, 141-148 (1983).
10) Arai, K., Madison, J., Shimizu, A., and Putnam, F. W.: Point substitutions in albumin genetic variants from Asia. Proc. Natl. Acad. Sci. USA, 87, 497-501 (1990).
11) Shimizu, A., Ashida, Y., and Fujiwara, F.: Measurement of the ratio of lecithin to sphingomyelin in amniotic fluid by fast atom bombardment mass spectrometry. Clin. Chem., 37, 1370-1374 (1991).
12) Hayashi, A., Wada, Y., Suzuki, T., and Shimizu, A.: Studies on familial hypotransferrinemia: unique clinical course and molecular pathology. Am. J. Human Genet., 51(7) (1993).
13) Nakanishi, T., Okamoto, N., Tanaka, K., and Shimizu, A.: Laser desorption time-of-flight mass spectrometric analysis of transferrin precipitated with antiserum: a unique simple method to identify molecular weight variants. Biol. Mass Spectrom., 23, 230-233 (1994).
14) Nakanishi, T., Miyazaki, A., Kishikawa, M., Shimizu, A., Kishida, O., Sumi, S., Tsubakio, T., and Imai, K.: A new hemoglobin variant found during Hb A1c measurement: Hb Hokusetsu [ β52(D3) Asp→Gly]. Hemoglobin, 22(4), 355-371 (1998).
15) Kishikawa, M., Nakanishi, T., Miyazaki, A., Hatanaka, M., Shimizu, A., Tamoto, S., Ohsawa, N., Hayashi, H., and Kanai, M.: A new nonamyloid transthyretin variant, G101S, detected by electrospray ionization/mass spectrometry. Hum. Mutat., Mutation in Brief #201 Online (1998).
16) Nakanishi, T., Kishikawa, M., Miyazaki, A., Shimizu, A., Ogawa, Y., Sakoda, S., Ohi, T., and Shoji, H.: Simple and defined method to detect the SOD-1 mutants from patients with familial amyotrophic lateral sclerosis by mass spectrometry. J. Neurosci. Methods, 81, 41-44 (1998).
17) Hatanaka, M., Maeda, T., Ikemoto, T., Mori, H., Seya, T., and Shimizu, A.: Expression of caveolin-1 in human T cell leukemia cell lines. Biochem. Biophys. Res. Commun., 253, 382-387 (1998).
18) Miyazaki, A., Nakanishi, T., Kishikawa, M., Nakagawa, T., Shimizu, A., Mawjood, A. H. M., Imai, K., Aoki, Y., and Kikuchi, M.: Compound heterozygosity for β+-thalassemi-31(A→G) and a variant with low oxygen affinity, Hb Sagami [ β139(H17)Asn→Thr]. Hemoglobin, 23(3), 257-271 (1999).
19) Kishikawa, M., Nakanishi, T., Shimizu, A., and Yoshino, M.: Detection by mass spectrometry of highly increased amount of S-sulfonated transthyretin in serum from a patient with molybdenum cofactor deficiency. Pediatric Research, 47, 492-494 (2000).
20) Nakanishi, T., Miyazaki, A., Iguchi, K., and Shimizu, A.: Effect of hemoglobin variants on routine HbA1c measurements, assessed by a mass spectrometric method. Clin. Chem., 46(10), 1689-1692 (2000).
21) Nakagawa, T., Ikemoto, T., Takeuchi, T., Tanaka, T., Tanigawa, N., Yamamoto, D., and Shimizu, A.: Eosinophilic peroxidase deficiency: identification of a point mutation and prediction of structural changes. Hum. Mutat., Mutation in Brief #401 Online (2001).
主要依頼原稿
1) Shimizu, A. and Watanabe, S.: “Preparation and radioimmunoassay of IgM domains," Methods in Enzymology, Vol. 73, ed. by V. H. Vunakis and J. J. Langone, Academic Press, New York, pp. 616-625, 1981.
2) Shimizu, A., Nakanishi, T., Kishikawa, M., and Miyazaki, A.: “Detection and Characterization of Aberrant Blood Proteins by LC/ESI/MS," Advances in Mass Spectrometry, Vol. 14, ed. by E. J. Karjalainen, et al., Elsevier Science B. V., pp. 405-418, 1998.
3) Shimizu, A., Nakanishi, T., Kishikawa, M., and Miyazaki, A.: Detection and identification of protein variants and adducts in blood and tissues, an application of soft ionization MS to clinical diagnosis. J. Chromatogr. B (2002).